Resumen
En esta práctica, por medio de la separación de mezclas, específicamente por el método de destilación, se logró separar alcohol etílico de una bebida alcohólica, en este caso una cerveza. Al extraer el alcohol se pudo determinar el grado de este en la bebida.
También se pudo comparar los grados de alcohol con otras bebidas alcohólicas para así notar cual tenía más grado de alcohol.
También se pudo perfeccionar el buen montaje de destilación ya que si este no se realiza de una manera adecuada los resultados se ven afectados.
Marco teórico
En la naturaleza las sustancias generalmente se encuentran en forma de mezclas o compuestos, los cuales para poder analizarlos en necesarios separarlos, para determinar sus propiedades fisicoquímicas. Los procesos físicos para determinar son los siguientes: decantación, filtración, evaporación, destilación, centrifugación, cristalización, cromatografía. Cada una se encarga de separar compuestos según su naturaleza, su estado, su reactividad, etc. De acuerdo a las propiedades de los compuestos y mezclas.
La destilación se basa en la separación de dos líquidos miscibles, este proceso se basa en el punto de ebullición de los
Líquidos ya que estos deben tener puntos de ebullición diferentes. Este proceso también es utilizado para la purificación de los líquidos. Existen tres formas de destilación: la destilación simple, la destilación fraccionada y la destilación con baja presión, esta última también es denominada destilación al vacío.
La destilación simple: se fundamenta básicamente en que los compuestos orgánicos que están contenidos en el líquido tengan una diferencia entre los puntos de ebullición bastante notables.
Se arma un equipo de destilación como en la fig.1 y se coloca a calentar la mezcla aquel liquido con menor punto de ebullición se evaporiza y por medio de un condensador se destila el líquido. Este procedimiento a pesar de servir para separar también es muy útil para la purificación de las sustancias.
La destilación fraccionada: en este caso se realiza en las mezclas donde los compuestos tengan puntos de ebullición deferentes pero poco notables, es decir, la diferencia entre estos es muy pequeña.
Esta contiene una columna de fraccionamiento la cual hace que el contacto entre los vapores y los líquidos condensados sea mayor, lo cual trae como consecuencia que el líquido con menor punto de ebullición se evaporice y el que tenga mayor punto de ebullición a pesar de estar también es estado gaseosos se convierta rápidamente a líquido.
La destilación al vacío: en este método la presión sobre la mezcla líquida de ser menos que su presión del vapor (generalmente menos que presión atmosférica) causando la evaporación de los líquidos más volátiles (ésas con el más bajo puntos que hierven). Este método de la destilación trabaja en el principio que ocurre el hervir cuando la presión del vapor de un líquido excede la presión ambiente. La destilación de vacío se utiliza con o sin la calefacción de la solución.
OBJETIVOS:
-
Manejar adecuadamente la técnica de destilación simple
-
Separar los componentes de una bebida alcohólica
-
Establecer los principios de la destilación simple.
MATERIALES:
REACTIVOS:
-
Bebida alcohólica
-
Permanganato de potasio
Procedimiento
Se armó un equipo de destilación como se muestra en la fig. 1.

Figura 1 montaje que se realizó en la práctica.
En balón de fondo redondo con desprendimiento lateral se agregó la bebida alcohólica, se le agrego a la bebida pedacitos de vidrio esto para evitar que se formen burbujas, seguidamente se procedió a calentar el compuesto, teniendo en cuenta la temperatura cuando en el enlermeyer cayó la primera gota del destilado, cuando acercaba a una temperatura aproximada a los 100 °C se suspendió el calentamiento y al destilado se le agregaron 5 gotas de permanganato de potasio. Se anotaron los resultados observados.
Resultados y discusión
Cuando se armó el equipo de destilación se enfatizó que la entrada del agua en el condensador fuese en la parte inferior de este y que la salida fuese en la parte superior, esto con el fin que el destilado se enfriase más rápido ya que si el agua está a contracorriente con el destilado este se enfría mas rápido porque de esta manera el agua absorbe mucho más calor, si se colocase en el mismo sentido el agua cae inmediatamente y no enfría el tubo interno del condensador lo que hace que no se condense correctamente el vapor del destilado. A la bebida alcohólica que en este caso fue cerveza, se le agregaron pedacitos de vidrios esto con el fin de evitar la formación de espuma ya que si esto se presentaba alteraba totalmente el procedimiento. Al ser una bebida alcohólica es lógico suponer que el destilado seria alcohol etílico y este en teoría se sabe que tiene una temperatura de 78°C pero a esta temperatura aún no se no el destilado esto se debía a que como era una mezcla en la cual también había agua, el alcohol etílico fácilmente podía formar enlaces con esta lo que hacía que variara la temperatura de ebullición.
A _______°C se empiezo a notar el destilado cuando se acercó la temperatura a los 100°C se suspendió el calentamiento ya que a esta temperatura el agua empieza a bullir y entonces se destilaría esta también y nos altera el resultado.
Al destilado recogido se le agregaron 5 gotas de permanganato de potasio esto se realizó con el fin de oxidar a el alcohol etílico, se suponía que se debía notar un cambio de color de violeta que es el color original del permanganato de potasio a marrón, estoy nos daba a entender que había oxidación lo que confirmaba la presencia de alcohol etílico en el destilado, pero al agregar el permanganato no fue mucho el cambio en la coloración lo que nos dio a entender que fue escaso el etanol en el compuesto esto se justifica ya que como la muestra era cerveza esta contenía un bajo grado de licor, lo cual se reflejó al agregar el permanganato.
Preguntas adicionales
El proceso de destilación simple se basa en el punto de ebullición de los compuestos que se encuentran en una mezcla ya que estos deben ser diferentes para que así el compuesto con menos punto de ebullición se vaporice y por medio del condensador vuelva al estado líquido.
Este proceso es de gran utilidad ya que se pueden tanto separar mezclas, como se pueden purificar las mismas.
-
Soluciones: son mezclas homogéneas las cuales entran formadas por 2 o más compuestos, los cuales no reaccionan entre si lo que quiere decir que cada uno tiene propiedades químicas diferentes y se encuentran en proporciones diferentes dependiendo de que mezcla sea. De acuerdo a las proporciones se le halla la concentración.
-
Fracción: es una cantidad recogida de una muestra, en un proceso de separación. En el proceso una mezcla se separa en las fracciones que tienen composiciones que varíen según un gradiente.
-
Mezcla homogénea: una mezcla homogénea es aquella en que los componentes no se pueden identificar a simple vista, solo se nota una fase, pero el hecho que solo se note una fase no quiere decir que los compuestos estén reaccionando de hecho estos se pueden separar por métodos físicos dependiendo la mezcla que sea.
-
Cambio físico: es el que ocurre externamente, lo que quiere decir que no existe alteración de su estructura, ósea no hay reacción química, no se reordenan los átomos y no se forman sustancias nuevas.
-
Cambio químico: en este si hay una reordenación de los átomos, lo que quiere decir que hay formación de nuevas sustancias, los cambios ocurren externamente.
-
Liquido homogéneo: es aquel que todos sus componentes se encuentran completamente diluidos, es decir, no hay particulas solidas ni en ningún otro de los estados en q la materia se puede encontrar.
Si relacionamos los conceptos antes definidos tenemos que están todos muy ligados a la experiencia la cerveza es una solución ya que es una mezcla homogénea al ser liquido obviamente es un líquido homogéneo, al calentar la cerveza sufre cambios físicos al separarse el etanol de la cerveza y este a su vez vendría siendo una fracción de la muestra al agregarle permanganato de potasio a la fracción en este caso etanol esta cambia de color lo que demuestra un cambio físico pero si analizamos la ecuación química de etanol y permanganato de potasio observamos que también hay cierto cambio químico ya que se obtienen nuevas sustancias.
Precisamente si se evapora todo el líquido no podría haber separación y de hecho en eso consiste la técnica separar líquidos los cuales sean homogéneos pero que sus compuestos tengan diferentes puntos de ebullición por ende no bulle el líquido totalmente, lo que no bulle es simplemente porque tiene un punto de ebullición mucho mayor al líquido que se alcanza a destilar.
La principal razón es que si se llena el balón el líquido va a saturar el refrigerante lo que hace que pueda salir liquido sin ser destilado, otra de las razones es porque si se llena al empezar a bullir se forman burbujas, que se pueden evitar con piedritas de ebullición, estas también pueden salpicar y colarse en el destilado.
La desventaja seria que se tendría problemas para recoger el destilado, en qué sentido, cuando se calienta la muestra a separar el primer líquido que se vaporice al ser un gas debe esparcirse por todo el recipiente para así empezar el proceso de destilación, si tenemos un muestras muy grande el gas se esparcirá mucho más, abra menos presión, lo que hace que sea poco el destilado que se recoja, además si se quiere obtener más destilado, tendría que postergar el calentamiento y si hacemos esto corremos el riesgo de que otro liquido con un punto de ebullición un poco más alta que la del primer líquido y entonces tendríamos dos destilados en uno.
En estos casos, se utiliza una destilación al vacío, ya que un líquido bulle cuando su presión de vapor se iguala con la P externa. si uno baja la presión, hace que la presión de vapor se iguale con la externa a una temperatura menor que la de ebullición normal, que es a 1atm de presión. Entonces, se puede destilar con una temperatura menor a la cual descompone. En este caso por medio del vacío se hace que la presión baje por ende la temperatura de ebullición también disminuirá.
La temperatura sería más alta, ya que al obtener el vapor del líquido este tiene su temperatura de ebullición que va a ser menor que el residuo ósea de lo que aún no ha alcanzado su punto de ebullición, mientras que si no estuviese húmedo por el condensado el termómetro marcaria la temperatura de la muestra que aún se está calentando
Y por ende sería más alta
-
Si se realiza el recorrido del agua en contracorriente con el vapor destilado el agua logra absorber todo el calor esto hace que el vapor del destilado se convierta rápidamente en liquido
-
Si se coloca de arriba hacia abajo el agua va a caer sin hacer ninguna presión, lo que hace que el tubo interno del condensador por donde va a pasar el vapor del destilado no se enfría lo suficiente esto hace que del condensador salga el vapor de lo que se pensaba destilar.
Conclusiones
Se puede concluir que la destilación simple es una técnica muy útil en el momento de separar gases, que está fuertemente ligada a los diferentes puntos de ebullición de los líquidos que compongan la mezcla a destilar. También que los resultados de la destilación dependen tanto de la muestra que se esté utilizando para este procedimiento y de los implementos de laboratorio ya que si utilizamos implementos con una capacidad que no sea la adecuada para la muestra se pueden alterar los destilados e incluso dañar el montaje.
Bibliografía
http://www.worldlingo.com/ma/enwiki/es/Fraction_(chemistry)
http://www.worldlingo.com/ma/enwiki/es/Vacuum_distillation
www.profeonline.com/…/otros_docs/destilacion_fraccionada.doc
DESTILACIÓN FRACCIONADA
La destilación fraccionada es una operación básica de la industria química y afines, y se utiliza fundamentalmente en la separación de mezclas de componentes líquidos.
La eficacia de la separación depende de múltiples factores como la diferencia de los puntos de ebullición de los componentes de la mezcla, la presión de trabajo, y otros parámetros fisicoquímicos de los componentes; por una parte, y del diseño y construcción del equipo, por otra parte.
El corazón de un sistema de destilación fraccionada, es la columna de fraccionamiento, de cuyo diseño (tamaño, número de platos, tipo de relleno, diámetro, etc.) depende en gran medida el éxito de la separación.
Existen numerosos procesos industriales, donde la destilación fraccionada es una operación clave y de suma importancia para la obtención y calidad de los productos fabricados.
A continuación se muestran algunas industrias y procesos que dependen en gran medida de las operaciones de destilación:
* Industria Petroquímica
En la industria del petróleo, siendo ésta una mezcla muy compleja de componentes químicos de estructuras, pesos moleculares, puntos de ebullición, etc., muy diversos; todos los procesos de separación, incluida la isomerización, el cracking térmico y catalítico, la alquilación, etc., se realizan con sistemas de destilación fraccionada a presión normal reducida.
* Industria de síntesis química
En la industria síntesis química, ya sea de materias primas o productos finos (química fina), se emplea la destilación fraccionada a presión normal, reducida, azeotrópica, etc., para lograr los distintos niveles de calidad de los productos, requeridos por los distintos mercados de aplicación.
Procesos químicos tales como, la esterificación, la hidrogenación y la oxidación catalítica, la alquilación y la acilación de Friedel-Crafts, la halogenación fotoquímica, etc., requieren de operaciones de destilación para purificar los productos de síntesis.
* Industria…
La destilación fraccionada del petróleo
Para obtener combustibles útiles es necesario fraccionar el petróleo en sus diferentes componentes.
Cuando se calienta la mezcla de distintos líquidos que constituye el petróleo, cada uno de ellos alcanza el punto de ebullición a una temperatura diferente, de modo que se convierte en gas y se separa fácilmente del resto, primero los productos más ligeros, que tienen la temperatura de ebullición más baja.
Cada fracción que se obtiene es un combustible de características distintas. A este proceso se le llama destilación fraccionada.
El 90 % del petróleo se emplea para la producción de combustibles. Por orden de separación, estos son los principales compuestos que se extraen del crudo:
- Gasolina y nafta, que suponen un 25 % del total.
- Queroseno y combustible para aviones.
- Gasóleo ligero y para motores Diésel.
- Gases pesados y gasóleo de calefacción.
- Lubricantes, ceras y fueloil. Asfalto.
El queroseno fue la primera sustancia que se logró separar del petróleo, y sustituyó al aceite de ballena como combustible en las lámparas. Y en 1895, con la aparición de los primeros vehículos, se separó la gasolina.
Destilación por arrastre de vapor
a) La destilación por arrastre con vapor es una técnica usada para separar sustancias orgánicas insolubles en agua y ligeramente volátiles, de otras no volátiles que se encuentran en la mezcla, como resinas o sales inorgánicas.
b) Cuando se tienen mezclas de líquidos que no son miscibles entre sí, se tiene un tipo de destilación que sigue la ley de Dalton sobre las presiones parciales.
c) Como resultado de este comportamiento, y cuando uno de los componentes es agua, al trabajar a presión atmosférica, se puede separar un componente de mayor punto de ebullición que el del agua a una temperatura menor a 100º (92º en el D.F.)
d) Debido a lo anterior, con esta técnica se pueden separar sustancias inmiscibles en agua y que se descomponen a su temperatura de ebullición o cerca de ella, por lo que se emplea con frecuencia para separar aceites esenciales naturales que se encuentran en hojas, cáscaras o semillas de algunas plantas (té limón. menta, canela, cáscaras de naranja o limón, anís, pimienta, etc,)
e) Los aceites esenciales también pueden aislarse de sus fuentes naturales por medio de la extracción con disolventes orgánicos.
f) Dependiendo de la técnica que se utilice para el aislamiento, será la pureza y rendimiento del aceite esencial.
DESTILACIÓN POR ARRASTRE DE VAPOR
La destilación por arrastre de vapor es un tipo especial de destilación que se basa en el equilibrio de líquidos inmiscibles. Según se ha visto anteriormente, la temperatura de ebullición de una mezcla de dos componentes inmiscibles es inferior a la temperatura de ebullición de cualquiera de ellos por separado.
Supóngase que se desea recuperar un hidrocarburo pesado, C18 H38, que impregna un residuo sólido. Como la volatilidad de este compuesto es muy baja, habrá que elevar mucho su temperatura para alcanzar una velocidad de vaporización y, por tanto, de recuperación apreciable. A veces, por diversas razones, no es deseable alcanzar estas elevadas temperaturas, (descomposición térmica de los productos, cambio en sus propiedades, etc). En estos casos, una solución técnica viable puede ser la destilación por arrastre de vapor. Esta operación se puede llevara a cabo de varias formas:
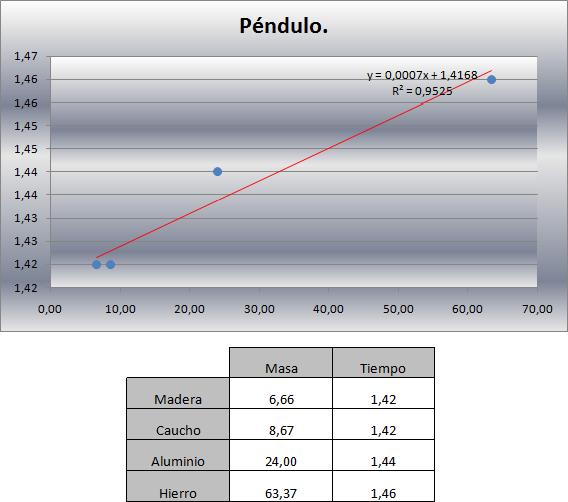
Modalidad 1: Se inyecta vapor saturado a través del residuo que contiene la sustancia a recuperar, mientras se mantiene una presión de operación de 1 bar. Parte del vapor condensará para calentar y vaporizar el hidrocarburo, formándose dos fases líquidas inmiscibles que alcanzan el equilibrio a una temperatura muy próxima a los : = 0,9993 + 0,0007.
La cantidad de vapor de arrastre necesaria por cada mol de hidrocarburos a recuperar es: mol de vapor/ mol de HC.
El consumo de vapor es, sin embargo, superior, ya que hay que contabilizar el vapor que condensa para calentar y vaporizar el hidrocarburo. Modalidad 2: Supóngase ahora que se inyecta vapor sobrecalentado y que, gracias al aporte de una fuente externa de calor, el vapor no condensa.
En estas condiciones, la relación de equilibrio es:
P = Pagua + PºHC , y la temperatura de operación se puede fijar independientemente para cualquier presión de operación. Asumiendo que ésta es de 1 bar y que la temperatura se fija en 204º C gracias a la fuente externa de calor, la presión parcial de vapor de agua será:
Pagua = 1 – PºHC (204º C) = 1 – 0,0442 = 0,9558.
Las necesidades de vapor serán ahora:
mol de vapor/ mol de HC
Puede observarse cómo al operar a mayor temperatura se reducen las cantidades de vapor de arrastre. En contrapartida, hay que aportar calor mediante una fuente externa que evita la condensación de parte del vapor.
Modalidad 3:
Es posible ahorrar más vapor aún, si se opera a presión reducida. En efecto, si se mantiene como temperatura de operación 204º C, pero la presión de operación se reduce a 0,2721 bar, la presión parcial que debe aportar el vapor de agua es:
El consumo de vapor de arrastre es ahora:
mol de vapor/ mol de HC
En este caso sigue siendo necesario aportar energía mediante una fuente externa para calentar y vaporizar el hidrocarburo y, además, emplear un sistema de vacío, que también consumirá energía.


 Esquema de una columna de fraccionamiento para destilación de petróleo
Esquema de una columna de fraccionamiento para destilación de petróleo  (minúscula).
(minúscula). (mayúscula).
(mayúscula). donde
donde  es la masa de la sustancia.1
es la masa de la sustancia.1 ) correspondiente a un cierto intervalo de temperaturas
) correspondiente a un cierto intervalo de temperaturas  se define en la forma:
se define en la forma:
 es la transferencia de energía en forma calorífica en el entre el sistema y su entorno u otro sistema,
es la transferencia de energía en forma calorífica en el entre el sistema y su entorno u otro sistema,  es la masa del sistema (se usa una n cuando se trata del calor específico molar) y
es la masa del sistema (se usa una n cuando se trata del calor específico molar) y  se define como:
se define como:
 . Esta función es creciente para la mayoría de las sustancias (excepto para los gases monoatómicos y diatómicos). Esto se debe a efectos cuánticos que hacen que los modos de vibración estén cuantizados y sólo estén accesibles a medida que aumenta la temperatura. Conocida la función
. Esta función es creciente para la mayoría de las sustancias (excepto para los gases monoatómicos y diatómicos). Esto se debe a efectos cuánticos que hacen que los modos de vibración estén cuantizados y sólo estén accesibles a medida que aumenta la temperatura. Conocida la función  a la final
a la final  se calcula mediante la integral siguiente:
se calcula mediante la integral siguiente:

 . El calor específico de los gases normalmente se mide bajo condiciones de presión constante (Símbolo:
. El calor específico de los gases normalmente se mide bajo condiciones de presión constante (Símbolo:  ). Las mediciones a presión constante producen valores mayores que aquellas que se realizan a volumen constante (
). Las mediciones a presión constante producen valores mayores que aquellas que se realizan a volumen constante ( ), debido a que en el primer caso se realiza un trabajo de expansión.
), debido a que en el primer caso se realiza un trabajo de expansión. (gamma).7 Este parámetro aparece en fórmulas físicas, como por ejemplo la de la velocidad del sonido en un gas ideal.
(gamma).7 Este parámetro aparece en fórmulas físicas, como por ejemplo la de la velocidad del sonido en un gas ideal.
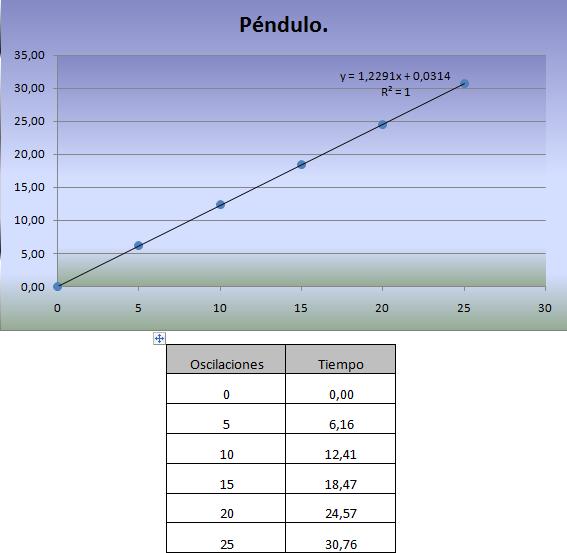


 , es casi sinusoidal; para mayores amplitudes la oscilación ya no es sinusoidal. La figura muestra un movimiento de gran amplitud
, es casi sinusoidal; para mayores amplitudes la oscilación ya no es sinusoidal. La figura muestra un movimiento de gran amplitud  (negro), junto a un movimiento de pequeña amplitud
(negro), junto a un movimiento de pequeña amplitud  (gris).
(gris).


 y
y  son dos constantes «arbitrarias» (determinadas por las condiciones iniciales) correspondientes a la amplitud angular y a la fase inicial del movimiento. Ambas tienen dimensiones de ángulo plano.
son dos constantes «arbitrarias» (determinadas por las condiciones iniciales) correspondientes a la amplitud angular y a la fase inicial del movimiento. Ambas tienen dimensiones de ángulo plano.


